全固体電池の開発加速か。3倍超の性能を実現させる新発見
次世代電池として実用化が待望される全固体リチウムイオン電池。その実現のカギを握る固体電解質を巡っては、日本を含め世界中で熾烈な開発競争が繰り広げられている。そうした中、東北大学の金属材料研究所と材料科学高等研究所により、室温において従来の3倍を超えるリチウムイオン伝導率を持つ固体電解質の材料が発見された。
この記事をシェア
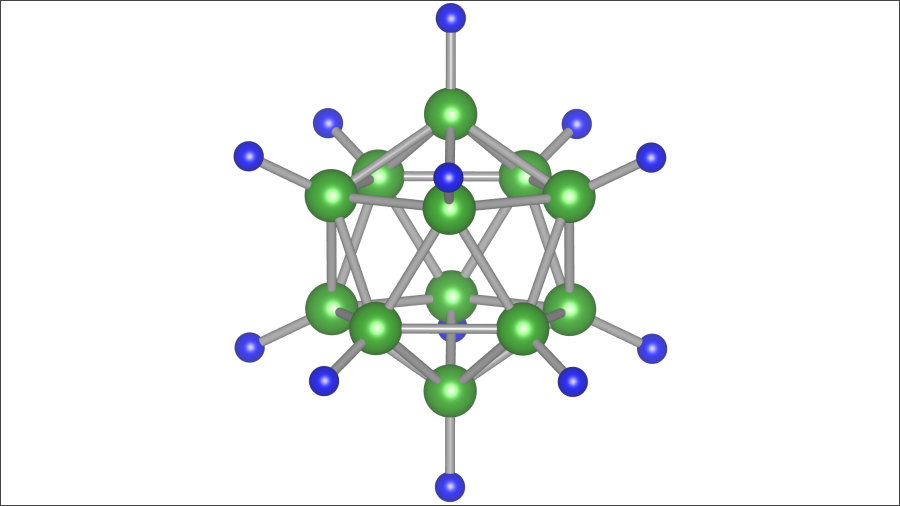
従来の固体電解質の材料である化合物「Li2B12H12」の錯イオン「B12H12](左)と、今回理論的に発見された化合物「Li5MoH11」の錯イオン「MoH9」(右)。画像提供:東北大学IMR/AIMR
東北大学の金属材料研究所と材料科学高等研究所は9月28日、全固体リチウムイオン電池(全固体LIB)のカギを握る「固体電解質」の材料として、これまでよりも遥かに低い”室温”で機能する化合物「Li5MoH11」を発見したことを発表した。
Li5MoH11は、原子番号42の遷移金属モリブデン原子(Mo)1個を中心として、水素原子(H)9個が結合した「MoH9」の組成の「錯イオン」と呼ばれるユニットを含む化合物だ。室温でのリチウムイオン伝導率は、従来の3倍以上という大幅な向上を達成した。ただし今回は理論的な発見のため、今後、実際に検証が行われる予定だ。今回の成果の通りなら、固体電解質の性能が大きく向上することになる。
固体電解質用の化合物「Li5MoH11」。5個のリチウム、1個のモリブデン、11個の水素で構成される。そのうちの核ともいえるのが錯イオン「MoH9」だ。画像提供:東北大学IMR/AIMR
全固体LIBが解決できる3つの課題
全固体LIBでは、有機電解液に代わってリチウムイオンを伝導させる役割を担う固体電解質が採用される。電解液を使わなくなることで、液系LIBが抱えている3つの課題を解決することが可能だ。その課題とは、(1)液漏れによる発火の危険性があること、(2)充電時間が長いこと、(3)バッテリーの重量1kg当たりのエネルギー容量(充電容量)を表す「重量エネルギー密度」がEVなどで使用するには不足しているという3点だ。
(3)について補足すると、量産用液系LIBの重量エネルギー密度は、理論的に250Wh/kg前後が限界とされ、そろそろ頭打ちを迎えつつある。しかしその数値を実現できたとしても、EVを普及価格帯で発売しようとしたらバッテリーの搭載量が限られるため、航続距離は250~350kmほどにとどまってしまう。ガソリン車と同程度の航続距離500kmのEVを普及価格帯で実現するには、500Wh/kgは必要だ。
この3つの課題は、全固体LIBなら克服することができる。まず(1)の液漏れによる発火の危険性は固体電解質の採用でなくなり、車載用として安全性が格段に高まる。(2)については、(1)の発火の危険性がなくなることに伴い、液系LIBでは不可能な、その1/3から1/4という短時間での急速充電も可能となる。急速充電による発熱で液漏れを起こす危険性がなくなるので、給油と同程度の5分ほどで満充電にできるという。さらに、(3)の重量エネルギー密度に関しても、全固体LIBの方が液系LIBよりも優れており、300~400Wh/kgを実現できるとされる(※1)。このように、全固体LIBの開発は、EVやプラグイン・ハイブリッド車の高性能化に直結するのである。
※1 全固体LIBの開発目標について:全固体LIBも、1種類が開発されているわけではない。2020年代前半から2020年代半ばの実用化を目指しているものは主に「硫化物系」といわれ、第1世代と呼ばれる。こちらの重量エネルギー密度の目標値は300Wh/kg前後だ。2020年代後半から2030年頃に実用化が期待されているのが、「先進硫化物系」または「酸化物系」の次世代全固体LIBで、こちらは400Wh/kg前後が目標。また全固体LIBには、硫化物系や酸化物系のほかに、ホンダなどが研究開発しているLIBとは異なる「フッ化物系」などもある。
ただし、本来は固体だとリチウムイオンが容易に負極と正極の間を移動するのは難しい。それを可能とする優れた固体電解質を完成させるには、高いイオン伝導率を有する材料が必要だ。その材料として有望視されているのが、「錯イオン」(※2)を含むイオン伝導体である。
※2 錯イオン:配位結合(共有結合の一種)や水素結合した分子を「錯体」といい、その錯体のうちで、正や負の電荷を帯びたものを錯イオンという。金属と非金属の原子が結合した化合物が多い。
高いイオン伝導率を実現するためには、錯イオンを回転させる必要がある。回転することで、材料中の陽イオン(LIBの場合はリチウムイオン)の動きを活発にし、それが高いイオン伝導率につながる。しかし、これまでの錯イオンは回転させるのが難しく、高い温度(=高い活性化エネルギー)が必要だった。室温程度の低い温度では回転させられないため、車載用としての利用が難しかったのである。
錯イオンが回転することでリチウムイオンが伝導しやすくなる理由は、実は100%わかっているわけではないという。高木准教授によれば、例えていうなら、固体電解質内の環境が錯イオンの回転で整えられ、リチウムイオンが進みやすいよう道路が通されるようなイメージになるのだそうだ。決して、回転する錯イオンがリチウムイオンを直接押したり引いたりするような仕組みではないという。
室温環境下で従来の3倍以上のイオン伝導率を有する材料を発見
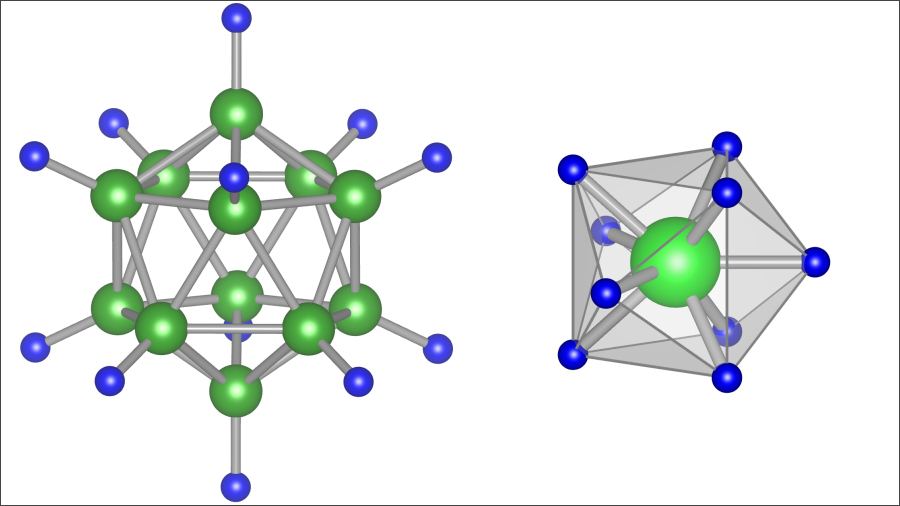
そうした中、東北大学金属材料研究所(IMR)の高木成幸准教授、同・佐藤豊人助教、東北大材料科学高等研究所(AIMR)の折茂慎一所長(教授)らの研究チームが理論的に発見したのが、化合物Li5MoH11内の錯イオンMoH9である。画像1のような構造をしており、中心の大きな緑の球体がモリブデン原子で、周囲に9個ある青の小型の球体が水素原子だ。
画像1。今回発見された、錯イオンの「MoH9」。中央の緑の球体がモリブデンで、周囲の青の球体が水素。画像提供:東北大学IMR/AIMR
MoH9は、錯イオンの中でもひとつの金属原子に多数の水素が結合した「高水素配位錯イオン」だ。これまでとは比較にならないほど、高いリチウムイオン伝導率を持つ。しかも、これまで実現できなかった室温のような低い温度(低い活性化エネルギー)で回転する。発見した高木准教授も、その低い温度には驚かされたという。
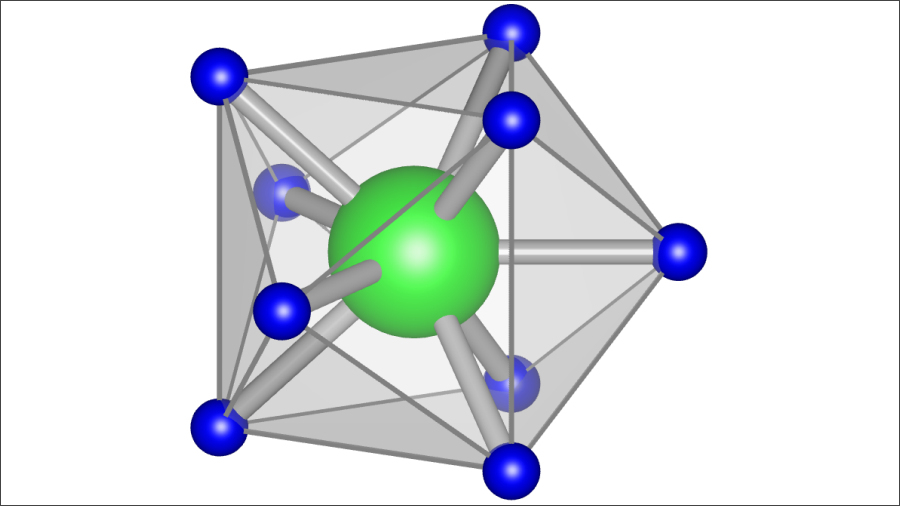
ちなみに、これまでは固体電解質用として研究されてきた代表的な錯イオンが、化合物「Li2B12H12」(画像2)に含まれる「B12H12」だ(画像3)。原子番号5のホウ素(ボロン)原子12個と水素原子12個からなる。しかしB12H12は回転はするが、高い温度を必要とすることが大きな短所だった。
従来の固体電解質の化合物「Li2B12H12」。画像提供:東北大学IMR/AIMR
画像3。固体電解質の材料の錯イオンとして、これまで研究されてきた「B12H12」。画像提供:東北大学IMR/AIMR
低い温度での回転を実現する物理現象とは?
今回発見されたMoH9が低い温度で回転する理由は、回転の仕方に秘密がある。B12H12も含め、分子全体が回転する通常の回転は「剛体回転」と呼ばれる。それに対してMoH9は、”回転しているのと等しい効果を得られる”「擬回転」という別の物理現象である点が大きく異なる。モリブデンと水素の結合の仕方に柔軟性があり、MoH9というひとつのユニットの中で水素の位置が変わること、それと同時にモリブデンもわずかに向きを変え、MoH9全体がわずかずつ変形していき、回転しているのと等しい効果を得られるのだ。
擬回転をCGアニメーションにより表したのが動画1だ。開始後11秒ほどのところで、MoH9がふたつ並ぶ場面となるが、左はMoH9の分子全体が回転する剛体回転(通常の回転)を表しており、右が擬回転。剛体回転と擬回転を見比べると、擬回転ではモリブデンがほんの少し向きを変え、そして水素が位置を変えるだけ。しかし剛体回転とはところどころで形が一致し、まるで回転しているように見える。つまり、剛体回転よりも効率よく動いているということだ。
動画1。「MoH9」の”擬回転”する様子。再生時間0分44秒。提供:東北大学IMR/AIMR
ちなみにB12H12だと、ホウ素同士が硬く結合しているため変形ができず、擬回転は不可能だという。剛体回転しかできず、分子全体で回転するため、それだけエネルギーが必要となってしまうのである。それに対してMoH9では、水素9個がモリブデンの周囲を移動するのと、それに合わせてモリブデンがわずかに向きを変える程度のエネルギーで済む。そのため、圧倒的に少ないエネルギーで回転しているのと同じ効果を得られるのである。
高木准教授らの研究チームでは、今回の成果は理論的な予測であることから、今後、実際に室温にて今回のL5MoH11を用いた実証実験を行う予定だ。また、擬回転は極めて一般的な物理現象であることから、ほかの高水素配位錯イオンを含む水素化物材料にも同じ戦略が適用できるという。全固体電池は、リチウムイオン以外にもナトリウムイオンやマグネシウムイオンなど、ほかの陽イオンを用いるタイプも研究されており、それらの開発にも役に立つ可能性があるとしている。